- 治疗贲门失弛缓症专家共识意见
- 发布于 2015-08-31 18:22 来源:于剑锋医生
贲门失弛缓症又被称为贲门痉挛、巨食管,是由于食管胃结合部(EGJ)神经肌肉功能障碍所致的功能性疾病,主要特征是食管缺乏蠕动,食管下括约肌(LES)高压以及对吞咽动作的松弛反应减弱。临床表现为吞咽困难、胸骨后疼痛、食物反流以及因食物反流误吸入气管所致咳嗽、肺部感染等。
贲门失弛缓症在我国尚缺乏流行病学资料,在欧美等西方国家的发病率每年约为1例/10万人,男女患病比例相似(1U1.15)。
贲门失弛缓症病因迄今不明,一般认为是神经肌肉功能障碍所致,与食管肌层内奥尔巴赫(Auerbach)神经节细胞变性、减少或缺乏以及副交感神经分布缺陷有关;在神经节细胞退变的同时,常伴有淋巴细胞浸润的炎症表现,或许该病与感染、免疫等因素相关。
该病的疗法主要包括药物、内镜和手术,旨在降低LES压力,使食管下段松弛,从而解除功能性梗阻。
经口内镜下肌切开术(POEM)是一种通过隧道内镜进行肌切开的微创新技术,2008年首次用于贲门失弛缓症的治疗。我国于2010年开始临床使用POEM,经过两年的迅速发展,目前已成为开展该技术最多的国家。
为规范POEM操作,并为各级医院提供一个适合我国国情的初步规范,遵照循证医学原则,参考现有国内外文献及专家经验,由复旦大学附属中山医院内镜中心牵头,起草了POEM治疗贲门失弛缓症专家共识意见。由于目前国内外可供参考的高质量循证医学证据有限,还不足以形成一个规范性文件或指南。本共识意见将随着POEM的发展和对远期疗效的随访而不断更新、完善。
诊断
临床症状
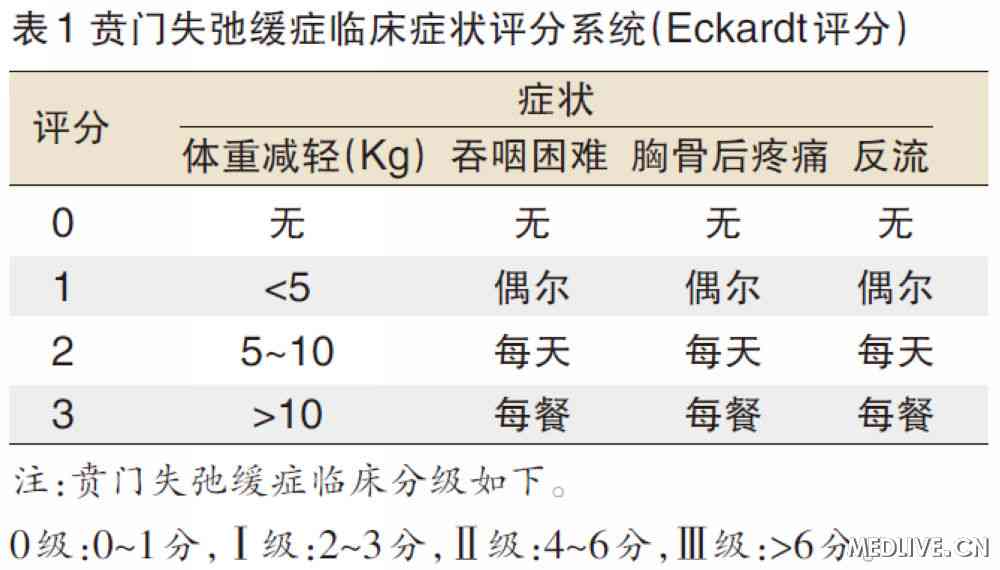
吞咽困难、反流、胸骨后疼痛和体重减轻是贲门失弛缓症的主要症状,推荐采用贲门失弛缓症临床症状评分系统(Eckardt评分)对贲门失弛缓症患者进行诊断、分级(表1)。
吞咽困难是最常见(>80%~95%)、最早出现的症状;病初时有时无,时轻时重,后期转为持续性。
食物反流和呕吐发生率可高达90%。呕吐多在进食后20~30分钟内发生,可将前一餐或隔夜食物呕出。在并发食管炎、食管溃疡时,反流物可含有血液。患者可因食物反流、误吸而引起反复发作的肺炎、气管炎,甚至支气管扩张、肺脓肿或呼吸衰竭。
约40%~90%的患者伴有疼痛,多位于胸骨后及中上腹。
体重减轻与吞咽困难影响食物摄取有关。病程较长患者的体重减轻、营养不良和维生素缺乏等表现明显,极少数患者可呈恶病质表现。在疾病后期,极度扩张的食管压迫胸腔内器官,可产生干咳、气急、紫绀和声音嘶哑等。
影像学检查
上消化道钡餐透视可见不同程度的食管扩张、食管蠕动减弱、食管末端狭窄(呈“鸟嘴”状)、狭窄部黏膜光滑,是贲门失弛缓症患者的典型表现。
亨德森等将食管扩张分为以下三级:
Ⅰ级(轻度)食管直径<4 cm;Ⅱ级(中度)食管直径为4~6 cm;Ⅲ级(重度)食管直径>6 cm,甚至弯曲呈S形(乙状结肠型)。
实时吞钡检查可定量评估食管排空能力,是一种简单、易重复的疗效评价工具。
CT、磁共振成像及超声内镜(EUS)等可作为上消化道钡餐透视检查的补充,以排除炎症、肿瘤等器质性疾病导致的假性贲门失弛缓症。
食管动力学检测
食管测压仍是诊断贲门失弛缓症的金标准,通常表现为食管平滑肌蠕动消失, LES松弛不全, LES压力常显著增高。
依据食管高分辨率测压(HRM)结果,贲门失弛缓症可分为三型:Ⅰ型(经典失弛缓症)表现为食管蠕动显著减弱而食管内压不高;Ⅱ型表现为食管蠕动消失及全食管压力明显升高;Ⅲ型表现为食管痉挛,可导致管腔梗阻。该分型可用于判断手术疗效:Ⅱ型患者疗效最好,而Ⅲ型患者对手术治疗反应最差。
胃镜检查
胃镜检查可排除器质性狭窄或肿瘤。内镜下贲门失弛缓症的特点包括:① 食管内残留中到大量的积食,多呈半流质状态覆盖管壁,黏膜水肿增厚,失去正常食管黏膜色泽;② 食管体部扩张,有不同程度的扭曲变形;③ 管壁可呈节段性收缩环,似憩室膨出;④ 贲门狭窄程度不等,直至完全闭锁不能通过。早期贲门失弛缓症内镜下可无显著异常,有时镜身通过贲门阻力感并不明显。
手术指征
适应证 确诊为贲门失弛缓症并影响生活质量者均可接受POEM治疗。
食管明显扩张、甚至呈S或U形的患者,既往外科Heller术(编者注:胸腔镜下食管下段贲门肌层切开术)和POEM治疗失败或症状复发者,术前曾接受过其他治疗(如球囊扩张术、肉毒素注射和支架治疗等)的患者,均可接受POEM治疗,但手术难度可能较大。
禁忌证 对合并严重凝血功能障碍、严重器质性疾病等无法耐受手术者,以及因食管黏膜下层严重纤维化而无法成功建立黏膜下隧道者禁用POEM。食管下段或EGJ有明显炎症或巨大溃疡者,是POEM手术的相对禁忌人群。
条件与准入
1.POEM应限于有合法资质的医疗单位开展。最基本的设备包括:带附送水钳道内镜,二氧化碳灌注装置,透明帽、切开刀、注射针、热活检钳、金属夹等,内镜专用高频电发生器等。所有器械应符合相关消毒灭菌要求,一次性物品应按有关规定处理,常用易损器械应有备用品。
2.POEM须由有合法资质的医师、助手及护士协同完成,团队中应包括有高级技术职称的医师,并由高年资主治医师以上、经正规培训的人员主持工作。
3.POEM的主要操作者应接受过规范化专业技术培训,具有从事内镜切除术的经验,如内镜黏膜切除术(EMR)或内镜黏膜下剥离术(ESD)等,完成不少于30例的食管病变ESD治疗,有处理手术并发症(如出血、穿孔)的经验。建议初期在有经验医师指导下,完成一定数量的病例后再独立操作,并从病程短、未经其他治疗的简单病例开始,再逐步过渡到复杂病例的治疗。
术前准备
1.通过病程、症状评分、既往治疗情况及多种术前检查,完成患者信息登记表,明确贲门失弛缓症的诊断及分级,评估手术难度及预期效果。有严重肺感染病史者术前应接受肺功能检查。
2.术前签署知情同意书,并告知可能的获益和风险。
3.术前流质饮食2天。手术当天行内镜检查,确认食管内无内容物潴留,以为手术提供良好的视野,并预防麻醉过程中的反流、误吸。
手术操作方法及要点
操作方法
麻醉及体位 所有患者均接受气管插管全身麻醉,仰卧位或左侧卧位,术前预防性静脉使用抗生素。抗生素的选择参照卫生部抗菌素使用原则。
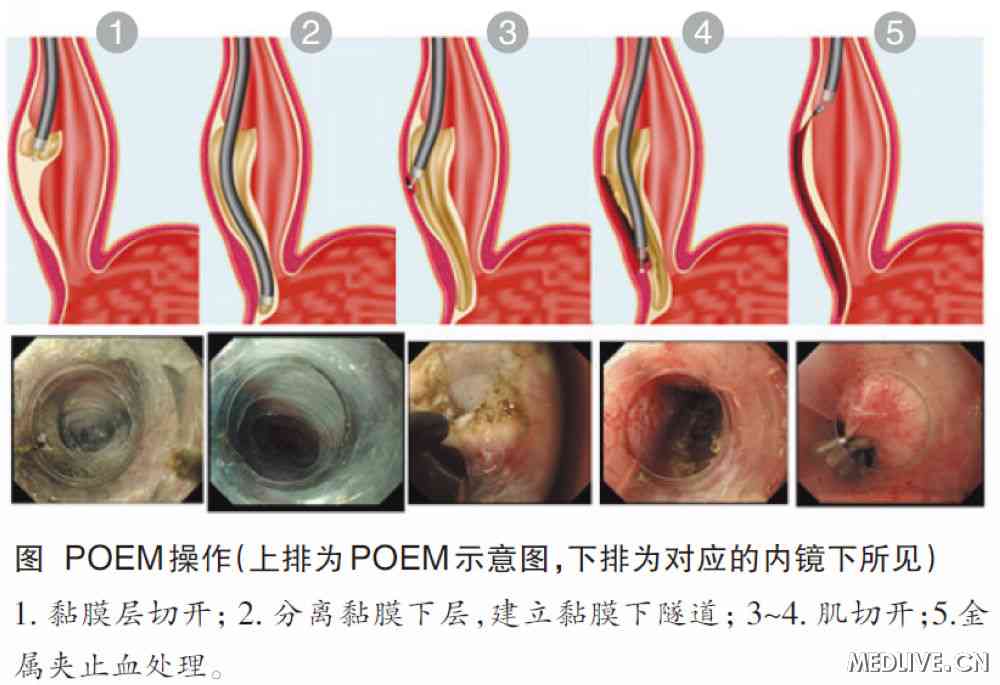
食管黏膜层切开 胃镜前端附加透明帽,确定EGJ距门齿的距离。常规于EGJ上方10 cm处行食管黏膜下注射,纵形切开黏膜层约1.5~2 cm显露黏膜下层。
分离黏膜下层,建立“隧道” 沿食管黏膜下层自上而下分离,建立黏膜下“隧道”,直至EGJ下方2~3 cm,尽量靠近肌层进行黏膜下层分离,分离中反复进行黏膜下注射,避免损伤黏膜层。分离中镜身退出黏膜下“隧道”进入胃腔,倒镜观察胃黏膜颜色改变,判断分离止点与EGJ的距离。对于乙状结肠型食管,可通过内镜前端附加的透明帽展平食管壁,但较困难。
根据以下指标判断是否到达EGJ:① 进镜深度;② 进镜阻力,当镜身接近EGJ时可感到阻力增加,通过并到达胃黏膜下层时阻力突然消失;③ 贲门处黏膜下层有栅栏状粗大的平行血管;④ 黏膜下层内血管分布――食管黏膜下层血管较少,而胃黏膜下层血管明显增多呈蛛网状。
肌切开 完全、有效、足够长的肌切开是保证POEM操作成功的关键。胃镜直视下从“隧道”入口下方2 cm处开始,自上而下、由浅入深纵形切开环形肌束至EGJ下方2 cm以上。对于创面出血点随时给予电凝止血。肌切开完成后确认胃镜通过贲门无阻力。为保证疗效,肌切开长度常规为8~10 cm,至少应超过EGJ下方2 cm。对于以胸痛和食管痉挛为主要表现的Ⅲ型贲门失弛缓症患者,肌切开范围应包括所有异常收缩导致的狭窄环,具体切开长度可通过内镜或测压判断;对Heller术后患者的肌切开部位常规选择原手术区对侧,以避免既往手术瘢痕粘连的影响。据复旦大学附属中山医院内镜中心500余例POEM手术经验,连同纵行肌在内的全层肌切开,可明显缩短手术时间,而并不增加手术相关并发症。为保证长期疗效,建议对症状严重患者行全层肌切开术,尤其是EGJ上下5 cm范围的全层切开。
金属夹关闭黏膜层切口 将黏膜下“隧道”内和食管胃腔内气液体吸净,冲洗创面并电凝创面出血点和小血管;用多枚金属夹对缝黏膜层切口。
术中并发症的处理
黏膜层损伤 对于手术过程中出现的黏膜层损伤甚至穿孔,特别是贲门部位,可在肌切开完成后,于食管腔内用金属夹夹闭;必要时可在胃镜监视下放置胃肠减压管。
术中气肿、气胸和气腹 术中皮下和纵隔气肿常无需特殊处理,一般可自行消退。对术中发生严重气胸(手术过程中气道压力>20 mmHg,血氧饱和度<90%,经急诊床旁胸片证实)者,予胸腔闭式引流后,常可继续手术。对于术中有明显气腹者,可用14g穿刺针于右下腹麦氏点穿刺放气。由于体内二氧化碳较空气弥散和吸收快,建议内镜治疗中使用二氧化碳灌注,一旦发生气肿、气胸或气腹,气体可被很快吸收。< span="">
术后处理
一般处理
术后当天禁食、补液、半卧位、心电监测,观察有无颈部和胸前皮下气肿。术后静脉使用质子泵抑制剂(PPI)3天,并使用抗生素(可选用第一、二代头孢菌素),但用药总时间不应超过48小时;对有气胸、大量出血、高龄及免疫缺陷患者,可酌情延长用药时间。
患者在术后应接受胸片、胸部CT检查,了解有无纵隔气肿、气胸、气腹和胸腔积液等。常规术后3天进流食,术后2周进半流食,术后口服PPI 4周。
并发症处理
气胸和气腹 术后如有纵隔、皮下气肿及轻度气胸(肺压缩体积<30%,患者呼吸平稳、血氧饱和度>95%,通常不需要特殊处理;对于肺压缩体积>30%的气胸,可用静脉穿刺导管于锁骨中线与第二肋间隙交界处行胸腔穿刺闭式引流;膈下有少量游离气体、无明显症状者,一般气体可自行吸收;如腹胀明显,可行胃肠减压,必要时用14G穿刺针行腹腔穿刺放气。
胸腔积液 POEM术后胸腔积液发生率约为40%。积液量少、无发热者,一般可自行吸收,无须特殊处理;对于积液量较大、影响呼吸、高热者,可在超声引导下尽快置管引流。
出血 POEM术后出血发生率较低。由于食管下段肌间隙小血管及侧支循环较丰富,因此手术时应随时冲洗创面并予及时电凝、彻底止血。
若患者在术后出现心率加快、血压下降、胸痛进行性加重或呕血、黑便,应考虑“隧道”内出血可能,此时应及时行胃镜探查,将创面及黏膜下隧道内的积血清除,尽可能暴露创面,用热活检钳电凝止血;如不能明确活动性出血点,可用三腔管食管囊压迫止血。对术后出血者应治疗性应用抗生素。
感染 主要包括黏膜下“隧道”感染、纵隔感染和肺部感染,是POEM术后可能发生的严重并发症。感染原因包括术前食管清洁不充分,术中、术后黏膜下隧道内出血、积液等。因此,术前应充分清洁食管,预防性使用抗生素;气管插管过程中防止误吸;对术中创面进行严密止血,夹闭“隧道”入口前反复用无菌生理盐水冲洗,确保黏膜切口夹闭严密。对于术后肺部炎症、节段性肺不张者,可加强化痰,并静脉使用抗生素。
消化道瘘 包括食管纵隔瘘和食管胸腔瘘等。保持食管黏膜完整性是预防瘘的关键。术中尽量减少黏膜层损伤,可采用金属夹夹闭穿孔;确保“隧道”入口夹闭严密。一旦出现瘘,可用食管覆膜支架堵塞瘘口,同时行胸腔闭式引流。
术后随访
随访旨在评估疗效、今早发现复发并监测远期并发症。
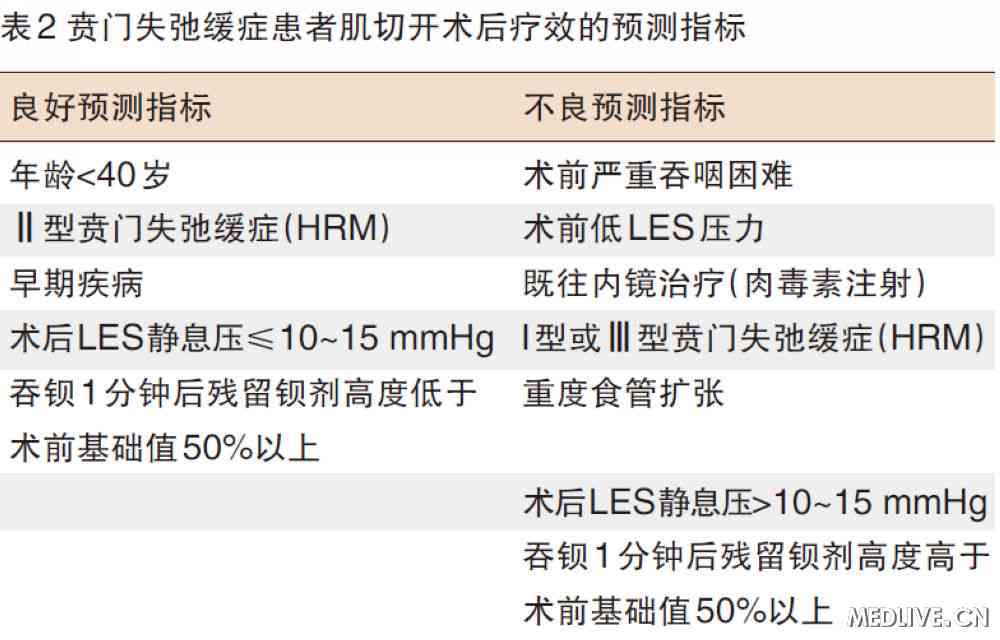
疗效评估 通常于术后2~4周进行,包括主观症状评估和客观检查。主观症状评估可采用症状评分系统,术后Eckardt评分≤3分者,认为手术有效;术后6个月内Eckardt评分≥4分者,考虑手术失败(表2)。客观检查包括胃镜检查、食管测压及实时吞钡检查等。胃镜检查可了解食管创面愈合及通过贲门口阻力情况。术后LES静息压≤10~15 mmHg是治疗长期有效的良好预测指标。实时钡餐透视可了解食管腔扩张和贲门口通畅度;吞钡1分钟后残留钡剂高度低于术前基础值50%以上,也是治疗长期有效的良好预测指标(表2)。
复发的早期发现 术后6个月以上、Eckardt评分≥4分者,结合食管测压、钡餐透视以及胃镜检查结果,可诊断为术后复发。术后复发的早期发现有赖于定期、规范的症状评估。通常术后每1~2年门诊或电话随访1次,进行Eckardt症状评分,也可直接通过周期性客观检查来监测术后复发。对于术后复发者,可做进一步治疗,包括再次POEM、内镜下球囊扩张术、放置可回收支架等。
远期并发症的监测 远期并发症主要为胃食管反流。患者在术后每1~2年应定期随访,评估有无胃灼热、反酸等症状,并经胃镜检查确定有无反流性食管炎,必要时可做24小时食管pH监测,以确诊胃食管反流(PPI通常有效)。对于年龄较大、病程10~15年以上、近期体重减轻明显的患者,应警惕贲门癌的发生。
