- Burkitt淋巴瘤最新诊治进展
- 发布于 2015-11-04 23:06 来源:黄程辉医生
Burkitt淋巴瘤(BL)是一种高度侵袭性的非霍奇金淋巴瘤,主要来源于B淋巴细胞,常有第8号染色体MYC基因的易位。BL主要有3种亚型,其流行病学、临床表现各有不同,但在基因学相似。对于大多数BL患者,早期高强度多药联合化疗效果较好。老年患者生存率较低,原因可能与化疗可导致相关毒性,从而降低药物剂量有关。
对于骨髓抑制较强的化疗方案,中枢预防、肿瘤溶解预防和治疗以及感染相关并发症的治疗都很重要。复发难治的BL患者预后较差,如果可能,推荐进行临床试验。
流行病学
地方性BL主要发生在中非一带,是该地区儿童最常见的恶性肿瘤,发病率每年大约在3-6例/10万。其发病与EBV感染高度相关。地方性BL也是巴布亚新几内亚的一种地方病。
在这些地区,Burkitt淋巴瘤的发生与地理、气候(雨林、赤道等)因素有关,这正好与疟疾的地理分布一致。虽然疟原虫并不具有致癌性,但地方性BL与疟疾的地理分布一致使人们猜想疟原虫感染是否可导致EBV具有致癌性。
HIV感染使免疫缺陷相关的BL风险增加,但该型患者EB阴性。散发性BL相当罕见,大约占儿童淋巴瘤的30%,占西欧和美国所有淋巴瘤的1-2%。该型的主要发病人群是年轻人,儿童的发病高峰是11岁,成人30岁。
免疫缺陷相关的BL在HIV患者中较常见。事实上,无论患者的CD4细胞计数多少,BL都可以发生。因此,在抗逆转录病毒治疗时代,该型患者的发病率并没有下降。
遗传学
BL存在Ig重链、轻链重排,具有Ig基因自体突变。所有病例都有MYC异位t(8;14)(q24;q32),少见的异位还有t(2;8)(2q11)或t(8;22)(22q11)。
MYC基因持续表达影响到14号、2号或22号染色体上Ig基因的起动子(这些基因分别编码Ig重链或Lambda、Kappa轻链)。MYC功能失调,促使细胞进入细胞增殖周期,这在淋巴瘤的发生中起了重要作用。
MYC还能激活靶基因,特别是与凋亡有关的基因。MYC基因中的突变进一步增加了它的致瘤性。其它遗传学改变包括TP53失活及继发突变,这些情况可见于30%的地方性和散发性Burkitt淋巴瘤。
值得注意的是MYC基因异位并非完全是Burkitt淋巴瘤所特有。例如有报道显示MYC异位见于继发于滤泡性淋巴瘤的前驱B淋巴母细胞白血病/淋巴瘤。
组织病理学
瘤细胞表达膜IgM、单一轻链、B细胞相关抗原(如:CD19、CD20、CD22)、CD10和bcl-6,但CD5、CD23和TdT呈阴性。不表达bcl-2。表达CD10和bcl-6说明肿瘤细胞起源于生发中心。
地方性Burkitt淋巴瘤表达CD21(一种C3d的受体),但散发性Burkitt淋巴瘤通常不表达。浆样分化的Burkitt淋巴瘤可出现单一型胞浆内Ig。核增殖指数非常高,近100%的细胞呈Ki-67+,与DLBCL相比,浸润的T细胞较少见。
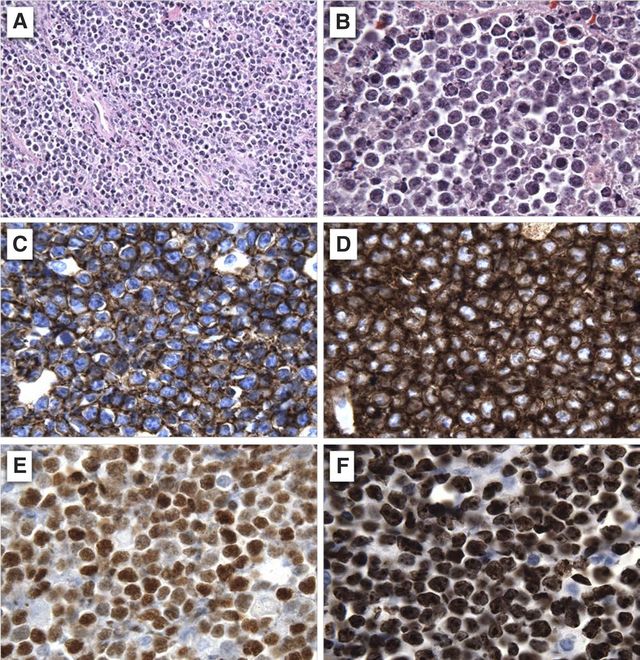
BL组织病理学特点
临床表现
多数患者表现为迅速增大的肿块,由于肿瘤倍增时间短、生长快,肿瘤有时会很快崩解,血清LDH很高。散发性BL最常见的临床表现是腹部肿块,骨髓和中枢神经系统侵犯的比例分别为30%、15%。
地方性BL可侵犯颌面部导致面部畸形,侵犯脑膜或脊髓,腹膜后淋巴结,肝肠肾等脏器,但骨髓受累并不常见。免疫相关的BL主要累及淋巴结、骨髓和中枢神经系统,有时外周血也可受累。
对BL患者首先应进行分期和预后评估,然后再进行病理学检查。BL和其他类型的B细胞侵袭性淋巴瘤形态学相类似,鉴别起来较困难,因此,应由有经验的血液病理医生进行切片。
实验室检查包括全血细胞计数、肝功能、LDH和尿酸,HIV和乙肝病毒也应常规检查。对BL患者进行分期不仅要做胸部、腹部和盆腔的CT,而且还需行PET-CT。骨髓活检也是必要的,对于中枢侵犯的患者,须行腰椎穿刺术和鞘内化疗。
墨菲分期系统(The Murphy stagingsystem)主要对儿童NHL进行分期,可预测患者的预后。根据肿块大小和部位、血清LDH,可将患者分为低危和高危。蒽环类化疗药有心脏毒性,化疗前对患者心功能评估也很重要。
如果患者出现高尿酸、高磷血症、高钾血症、LDH升高,很可能出现了肿瘤崩解,治疗前应立即使用别嘌醇、静脉补液和拉布立酶(rasburicase)。
目前进行的BL新药临床试验,患者预后都较好,生存率可到75-90%。但SEER数据库的一份调查却令人失望:BL患者5年生存率只有56%,年轻低危患者要高一点。年龄对患者预后的影响是多因素的。
治疗
BL目前还没有标准的治疗方案,研究结果表明化疗方案中包含阿霉素、烷化剂、长春新碱和依托泊苷这四种化疗药物疗效较好。
1980年代,Magrath及其同事首次用CODOX-M/IVAC方案(环磷酰胺、阿霉素、长春新碱、氨甲喋呤、异环磷酰胺、阿糖胞苷和依托泊苷)治疗BL。在此之前,治疗BL的常用方案是CHOP+甲氨蝶呤,但超过一半患者复发。
Magrath及其同事对低危患者(单个肿块<10cm或腹部肿块完全切除、ldh正常)用3个疗程的codox-m方案化疗,其他所有患者接受2个疗程的codox-m和ivac方案化疗。< span="">主要毒性包括严重的骨髓抑制和感染,包括败血症。41例患者(21例成人,中位年龄25岁)2年的EFS为92%。
虽然成人BL患者用CODOX-M/IVAC方案治疗效果没有儿童和年轻患者好,但也取得了预期结果。在该研究中纳入的非典型BL患者OS都很低,因为有证据表明这部分患者有些是double-hit淋巴瘤。
另外一项纳入52例BL患者(中位年龄35岁)的研究,患者接受CODOX-M/IVAC方案化疗,低危和高危患者2年的OS分别为82%、70%。大部分患者出现了骨髓抑制,20%未能完成所有化疗。
随后的研究中,研究人员改变了化疗剂量,共53例患者纳入研究,中位年龄37岁。对于年龄<65岁的患者,甲氨蝶呤的剂量为3gm/m2,对于年龄>65岁的患者,甲氨蝶呤减量为1 gm/m2,阿糖胞苷减量为1
gm/m2。所有患者2年的PFS为55%,低危和高危患者的PFS分别为85%、49%。
同样地,CALGB协作组用另外一种方案治疗BL,化疗前用环磷酰胺和泼尼松降低肿瘤负荷,然后交替给予异环磷酰胺、甲氨蝶呤、长春新碱、阿糖胞苷、依托泊苷、地塞米松方案和环磷酰胺、甲氨蝶呤、长春新碱、阿霉素、地塞米松方案,各3个疗程。
治疗开始时,患者接受2400cGy的头颅放疗和12个疗程鞘内化疗。由于出现严重的神经系统毒性,研究人员改变了试验设计,只有骨髓侵犯的患者接受放疗且将IT化疗方案减少为7个疗程。92例患者5年的OS为52%。
随后的研究中,105例患者另外接受了2-7个疗程单药利妥昔单抗化疗,2年的EFS和OS分别为74%、78%。7例患者因严重的毒副反应死亡。
MD
Anderson的研究人员用HyperCAVD方案治疗急性淋巴细胞白血病和BL。Hyper-CVAD方案由A、B方案组成,A方案化疗药物包括:环磷酰胺、多柔比星、长春新碱、地塞米松;B方案化疗药物包括:甲氨蝶呤、阿糖胞苷。两种方案交替使用,都为4个疗程。
刚开始的研究共纳入26例患者,5例患者在诱导治疗时死亡。3年总的OS为49%,年龄<60岁和年龄>60岁患者的OS分别为77%、17%。随后的前瞻性研究共纳入31例患者,在HyperCAVD方案基础上加上利妥昔单抗,患者3年的OS显著提高,达89%。
欧洲其他协作组把治疗ALL的方案引入到BL中。法国LMB协作组根据患者的危险程度选择不同的化疗方案治疗ALL(L3)和BL。I期和II期的BL患者接受3个疗程的长春新碱、环磷酰胺和多柔比星化疗。
高危患者接受8个疗程的化疗,化疗方案中的药物包括:大剂量的甲氨蝶呤、阿糖胞苷、依托泊苷和鞘内甲氨蝶呤化疗。其他患者接受5个疗程类似高危患者的化疗方案。2年的EFS和OS分别为65%、70%。
利妥昔单在BL中的作用
与其他类型的B细胞NHL相比,利妥昔单抗在BL治疗中的作用还不清楚。一项纳入257例BL患者的大型研究,初步结果表明加入利妥昔单抗可显著延长患者3年的PFS和OS。
HyperCAVD方案联合利妥昔单抗也显示出较好的疗效,年龄和支持治疗影响治疗效果。同样的研究比较了CODOX-M/IVAC方案联合利妥昔单抗和CODOX-M/IVAC方案的疗效,结果显示,联合利妥昔单抗可延长患者的PFS和OS。
造血干细胞移植
有几个研究评价了BL患者第一次缓解后行造血干细胞移植的疗效。纳入的患者共45例,造血干细胞移植前的诱导方案较弱。由于部分患者对治疗不敏感,最后仅有27例患者行造血干细胞移植。3年的EFS和OS分别为42%、45%。该研究结果强调了快速大剂量多药化疗的重要性。
HOVON协作组评价了2个疗程大剂量化疗,随后行造血干细胞移植治疗BL的疗效。化疗药物包括:环磷酰胺、阿霉素、依托泊苷、米托蒽醌;预处理方案为BEAM。27例患者5年EFS和OS分别为73%、81%。
一项对117例BL患者回顾性研究发现,第一次完全缓解后行造血干细胞移植患者的3年OS达53%。移植时患者的疾病状态可影响预后,第一次完全缓解患者的3年OS为72%,37%的患者对化疗敏感,只有7%的患者对化疗不敏感。
复发难治性BL
对于初始治疗失败的BL患者,疾病会很快进展。目前很少有研究比较挽救治疗方案对这部分患者的疗效,因为大部分患者已经接受了很强的化疗。如前文所述,对化疗敏感的患者可以达到长生存,耐药患者预后较差。
HIV阳性的BL
最近几项研究结果表明,HIV阳性BL患者的治疗效果与HIV阴性患者类似。除REPOCH方案外,HIV阳性BL患者接受化疗的同时须抗病毒治疗。
118例(80例HIV阳性、38例HIV阴性)患者接受利妥昔单抗联合高强度化疗方案治疗,I-II期患者接受4个疗程化疗,其他患者接受6个疗程,>55岁患者须减量。结果表明HIV阳性和阴性患者DFS无明显差异。
总结
BL是一种高度侵袭性疾病,常有MYC基因的易位,利妥昔单抗联合多药大剂量化疗方案可取得较好疗效。大剂量化疗可导致骨髓抑制,有时甚至会出现危及生命的并发症。针对BL的靶向药物目前正在研究,有望给BL患者带来希望。
