- 神经内镜第三脑室造瘘术(ETV)治疗阻塞性脑积水
- 发布于 2009-05-13 22:08 来源:王镛斐医生
神经内镜技术始于20世纪初。1922年,Dandy通过Velly膀胱镜对二例脑积水患者作了脉络丛电凝和切除的尝试。1923年Mixter为一位9个月的患儿施行了世界上第一例内镜下第三脑室造瘘术[1],获得成功。但由于神经内镜和手术器械工艺简陋、手术死亡率高、效果差,三脑室造瘘术未能获得大规模推广,而脑积水颅外分流术由于相对安全、简单,逐渐取代了三脑室造瘘术。近年来,随着神经影像学、神经内镜制造工艺、显微手术器械及立体定向神经导航系统的飞速发展,使得神经内镜辅助三脑室造瘘术的手术方法日益成熟,适应证不断拓宽,在非交通性脑积水手术治疗领域发挥越来越大的作用。本文着重就手术适应证、手术方法、手术效果及其判断指标、手术并发症、手术优越性和发展前景等方面进行综述。
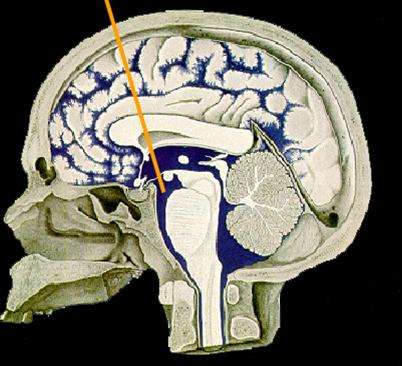
一、适应征
三脑室造瘘术主要适用于非交通性脑积水,因为三脑室造瘘术成功有两个前提:患者的脑脊液吸收能力正常;蛛网膜下腔脑脊液循环通畅,所以选择不同病因的脑积水患者对手术结果产生直接的影响。成功的三脑室造瘘术是指患者症状改善,颅内压降低,脑室有不同程度的缩小,无须再行分流术。总体来说:阻塞性脑积水可以取得较满意的手术成功率,中脑导水管狭窄、顶盖和丘脑肿瘤、后颅窝肿瘤、松果体区肿瘤、颈髓脊膜膨出、囊肿等所致的阻塞性脑积水,手术成功率为83%-95%。因此,由三脑室后半部至四脑室出口处之间的任何占位引起的阻塞性脑积水是三脑室造瘘术的最佳适应证。对于儿童脑积水患者,1岁以下的婴儿手术成功率较低(0%-23%),而 2岁以上的儿童患者手术效果较好,与成人相仿。大多数作者认为手术成功率与患者的年龄成正比。
二、方法
1、术前CT和MRI等影像学资料的复习 (1)确诊非交通性脑积水。(2)判断手术可行性。(3)确定手术钻孔(burr hole)位置。通过MRI矢状位和冠状位片, Monroe氏孔和靶点(造瘘口)的连线向皮肤表面延伸,交点即钻孔位置,一般位于冠状缝前1cm、中线旁开3cm。
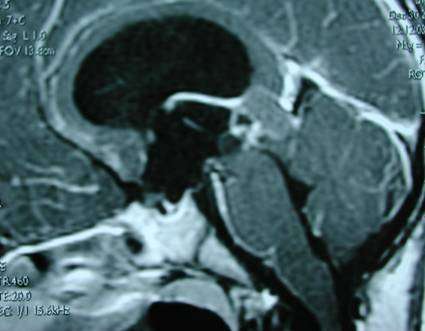
2、术前准备
(1)神经内镜系统。由脑室镜、光源、摄像机和监视器组成。包括工作鞘和硬质内镜。工作鞘由内镜通道、操作通道、冲洗和引流通道四部分组成。脑室镜工作鞘的外径一般小于8mm,否则会造成脑组织和小血管的损伤,以4.5mm(13.5F)和6mm(18F)多见,儿童患者多采用3.2mm(9.5F)。内镜视角有0、15、30、45、60 、90度和110度之分,实际操作过程中多应用0度和30度。硬质内镜具有成像清晰、色彩还原逼真、景深大和耐高温高压灭菌等优点,视角广,但同时应注意视野中物体变形。
(2)操作器械。包括Fogarty球囊导管、激光、单极或双极电凝、水切割、微型钳[9]甚至内镜本身[10]。Fogarty球囊导管操作简单、安全和有效,多作为首选。激光、电凝等极可能误伤脚间池内的基底动脉,不建议采用。
(3)麻醉和体位。采用全身麻醉。仰卧位,头附曲,Mayfield头架固定。
3、手术操作
(1) 颅骨钻孔。为了使骨孔、Monroe氏孔、造瘘口在一直线上,一般取右侧冠状缝前1cm、中线旁开3cm处行颅骨钻孔,骨孔直径约1.5cm。
(2) 侧脑室前角穿刺。术中脑针常规侧脑室前角穿刺成功后,顺原路将硬质神经内窥镜插入侧脑室。
(3) 确认靶点。Monroe 氏孔的后界是侧脑室脉络膜丛,前界是穹隆柱,后内侧有脉络膜静脉、丘纹静脉和透明隔静脉的联合。神经内窥镜进入三脑室,乳头体前方最窄细的部分是三脑室底,进一步向前是漏斗隐窝,其表面是粉红色,其边界是视交叉。造瘘口一般选择在漏斗隐窝与乳头体之间,呈半透明的、带蓝色的无血管薄膜是比较理想的穿刺部位; 如果斜坡与乳头体间的间隙较为狭窄,造瘘口应在乳头体的正前方。Zohdi认为宜选择位置相对固定的基底动脉和斜坡作为解剖标志,希望造瘘口尽量接近鞍背而远离搏动的基底动脉以防止损伤基底动脉及其分支[3,4]。立体定向有助于引导内镜以合适的角度进入侧脑室及Monroe 氏孔,当内镜进入脑室内后,就可在直视下进行操纵。某些由于颅内占位而导致解剖变异的病人,或者由于颅内出血、感染导致脑脊液浑浊的病人,就十分必要在立体定向神经导航下操作。运用无框架神经导航系统的立体定向神经内窥镜,通过立体定向设计最理想的轨道,在立体定向的引导下和神经内窥镜的直视帮助下,精确定位于靶点且不影响周围重要的神经血管组织。术中利用微血管Dopple探头经内窥镜进行血管超声探测,能对基底动脉和大脑后动脉进行术中实时定位(Real-time View),从而避免造瘘时损伤血管。这在血管走行变异,尤其在术中直视下无法清晰辨认三脑室底部的解剖结构时显得尤其重要。
(4)造瘘。以最常用球囊导管为例,在直视下定位后,先以3F球囊导管钝性头端穿过三脑室底,再向球囊内缓慢注入0.2毫升生理盐水,将瘘孔扩大,之后再将球囊抽空,或换用4F、5F、6F的球囊,如此反复进行,直至瘘口直径达到5-6mm以上。采用球囊扩张导管行穿孔造瘘, 因为导管质地较软, 头端钝圆,在穿通过程中若遇到血管则会自动滑开,导管头端穿通后,在球囊缓慢充水扩张时,亦会将邻近的血管轻轻推开,可避免血管的意外损伤。如果三脑室底膜很韧或很有弹性,可用电凝、弯头探针[11]和微型钳[9]进行锐性造瘘。不少作者[3,9,10,11,14]认为,钝性造瘘比锐性造瘘要安全些。无论用何种方法,前提是既能形成足够大的瘘口,又尽量避免损伤基底动脉。造瘘成功后,须将内镜通过瘘口观察桥前池结构,确保三脑室与桥前池相通,避免因未发现第二层膜(Likiequist’s膜)而使得造瘘失败。术中可采用数字动力学减影脑室造影(DDSV),以证实脑脊液循环通路的恢复情况,控制三脑室造瘘的开放程度[5]。术中以0.98~1.4Kpa的压力冲入37℃温盐水或林格氏液,冲去组织碎片和血液,防止脑室塌陷,保持术野清晰。
4.术后疗效判断。如果造瘘有效,患者术前存在的颅高压症状应不复存在。术后常规进行的CT和MRI检查可以帮助判断三脑室造瘘术的手术效果。一般可用两个指标:脑室大小,造瘘口脑脊液流量。前者以侧脑室额角、枕角和三脑室的最大横径为测量尺度,大多数患者(76%-90%)在一个月内可有不同程度的缩小,但很少能恢复到正常大小,一般两年以后不再有变化[5,6];后者行自旋回波的T1W和T2W的MRI检查,利用二维相位对比(2D-PC)技术来测定脑脊液流量[6]。
术前通过CT或MRI确定为非交通性脑积水患者,,穿过Monro氏孔,然后使用球囊、微型钳、电凝等方法在第三脑室底双乳头体前膜无血管处形成一个直径约5-6cm的瘘口。术后常规复查CT或MRI以确定手术效果。
三、并发症
总体来说,三脑室造瘘术的并发症发生率较分流术低,5%-7%左右[3,14],包括术中静脉出血、基底动脉破裂、术后颅内出血、感染、短暂意识丧失或下丘脑功能低下,大多为一过性。其中最危险的并发症就是基底动脉及其分支破裂引起大出血。Walker曾报道一例三脑室造瘘术致大脑后动脉穿通破裂大出血[14],就是使用了不恰当的器械导致的。为避免动脉破裂大出血,必须根据三脑室底的实际情况而选用合适的造瘘方法。当三脑室底膜较紧张、不易被推动时,钝性造瘘(如球囊导管等)是容易成功的;当三脑室底膜较松弛或富有弹性时,锐性造瘘就可大显身手了。然而,诸如激光、电凝等具有致热效应的方法对三脑室底下面的“Willis环”威胁太大。Philippe使用一种特殊的有齿微型钳[9],Kehler发明一种尖端弯向斜坡的探针[11],都可以降低风险。笔者采用球囊导管钝性造瘘,无一例出现基底动脉破裂。
四、手术优越性
与脑积水颅外分流术相比,主要有以下优点:(1)三脑室造瘘术没有分流管等异物植入,可以避免因分流装置导致颅内或腹腔感染,进而分流管堵塞而使分流术失败。(2)采用三脑室造瘘术,术后脑室内的脑脊液能直接流入脚间池而进入脑与脊髓的蛛网膜下腔内吸收,因而比脑脊液颅外分流术更符合脑脊液循环正常生理状态,可以有效的维持颅内正常的压力平衡和脑脊液的生理功能。(3)三脑室造瘘术的脑脊液流动速度均匀,不会出现因分流管虹吸导致的分流速度随体位改变而产生的波动,不会产生脑脊液过度引流。(4)不受儿童生长发育的影响,避免多次换管手术的痛苦。(5)手术操作相对较简单,手术时间较短(一般40min左右)[3]。(6)三脑室造瘘术可以用于分流失败或分流管感染粘连的非交通性脑积水患者,同样获得较好的疗效(成功率76%-84%)[13]。对于多次分流管堵塞而致分流失败的患者来说,三脑室造瘘术无疑是一种上佳的替代疗法。
微侵袭神经外科是当今神经外科的发展趋势,而神经内窥镜手术的逐渐完善和成熟正是适应了这种要求。根据Hopf关于内窥镜技术的分型,三脑室造瘘术是属于“纯内窥镜神经外科”。正确选择合适的脑积水病患者,采用良好的手术器械,熟练掌握手术方法和操作技巧,可以提高手术的安全性及有效性。三脑室造瘘术作为一种新的手术方法,已成为非交通性脑积水的首选治疗手段。
