- 原发性骨髓纤维化如何治疗
- 发布于 2011-12-03 09:08 来源:胡晓慧医生
原发性骨髓纤维化(PMF)是造血干细胞(HSC)异常所致的克隆性骨髓增殖性疾病,与真性红细胞增多症(PV)、原发性血小板增多症(ET)同属于BCR-ABL阴性的骨髓增殖性肿瘤(MPN)。其发病机制可能与造血干祖细胞的获得性突变引起激酶信号途径失调、异常细胞因子表达和克隆性骨髓增殖有关。PMF以骨髓纤维组织增生并髓外造血为特点,出现进行性贫血、脾脏肿大、外周血幼稚细胞、泪滴状红细胞和骨髓干抽,伴有发热、乏力、盗汗、消瘦等全身症状。PMF在MPN中预后最差,中位生存期约5年,最终将进展为骨髓衰竭或转化为急性白血病。
表1 DIPSS-plus危险分组
危险分组 积分值 中位生存期(年)
低危 0 15.4
中危-1 1 6.5
中危-2 2-3 2.9
高危 ≥4 1.3
2009年国际协作组(IWG-MRT)颁布了PMF的国际预后积分系统(IPSS),但仅适用于初诊未治疗的患者。2010年提出了国际动态预后评分系统(DIPSS),适用于处于疾病任何时点的患者。近期又提出国际动态预后评分系统加强版(DIPSS-plus),综合了核型、血小板计数和输血状态的预后信息(表1)。预后不良因素包括年龄>65岁、全身症状(诊断前1年体重下降>10%、不明原因的发热、严重盗汗超过1个月)、HGB<100g/L、PLT<100×109 wbc="">25×109/L、外周血原始细胞≥0.010、输血依赖、不良核型 [复杂核型、+8、-7/7q-、i(17q)、inv(3)、-5/5q-、12p-或11q23] [1]。
PMF的治疗方法包括造血干细胞移植、常规药物、手术切脾、放疗以及临床试验性药物治疗。根据预后分组选择治疗策略,有学者建议根据DIPSS-plus预后评分选择治疗方案(图1)[2]。
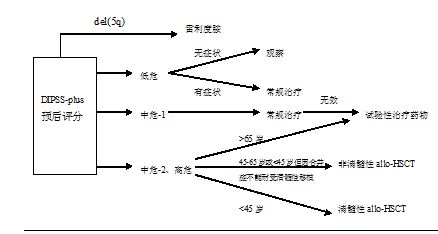
图1 原发性骨髓纤维化患者的治疗选择
一、异基因造血干细胞移植(allo-HSCT)
allo-HSCT是目前唯一可能治愈PMF的方法,适用于预后差且有合适供者的患者。Stewart等[3]选取51例PMF患者分别进行清髓及非清髓性预处理的allo-HSCT,3年总生存率分别为44%和31%,复发率分别为15%和46%,非复发死亡率分别为41%和32%,慢性移植物抗宿主病(GVHD)的发生率分别为30%和35%。清髓性及非清髓性allo-HSCT疗效相当,前者适于年轻患者,后者适于年龄偏大或由于并发症不能耐受清髓性移植的患者。对移植后复发的患者,有学者建议输注供者淋巴细胞发挥移植物抗骨髓纤维化(GVM)的作用。
allo-HSCT的预后不良因素包括IPSS中危-II/高危、输血依赖、不良核型、无关供者或同胞供者HLA非全相合、年龄大、显著脾脏肿大和骨髓硬化等[4]。一组多中心研究结果显示,具备移植指征的高危或中危PMF患者未经移植时1年和3年总生存率为70.5%~90.5%和55.0%~77.2% [5]。因此需要综合考虑患者的预后分组和预计生存质量决定是否移植。
二、常规药物治疗及进展
1、改善贫血:HGB<100g/L时开始治疗。常规药物包括糖皮质激素(0.5~1.0mg・kg-1・d -1)、雄激素(达那唑200mg,每日3次或司坦唑醇2mg,每日3次)、红细胞生成素(EPO)(3~5万U/周,皮下注射)和免疫调节剂,单药治疗PMF贫血的反应率30%~40%。初治患者可联合雄激素与皮质激素治疗,至少3个月,如果疗效好,雄激素继续服用,皮质激素逐渐减量[6]。EPO适用于血清EPO<100U/L的患者,对输血依赖的患者效果欠佳,用于中度以上的脾脏肿大患者可能会加重脾大。以上药物均有不足之处,根据患者的年龄及耐受情况等选择合适的药物。
免疫调节剂具有抗血管新生、下调TNF-α和IL-6、上调IL-2和IFN-α及增强T细胞和NK细胞增殖与活性的作用。沙利度胺能改善PMF患者的贫血、血小板减少和脾脏肿大,单独用量为100~400mg/d,从小剂量(50~100mg/d)开始,总有效率约为60%。主要不良反应包括神经毒性、便秘、血小板增多、嗜睡、头痛、口干、皮疹等,部分患者不能耐受。
Mesa等[7]采用小剂量沙利度胺(50mg/d)联合泼尼松(起始剂量0.5mg・kg-1・d -1)治疗21列PNF患者,泼尼松3个月后逐渐减量,其中20例患者完成了3个月的治疗,总有效率为62%;8例PLT<100×109/L的患者治疗后有6例(75%)血小板上升50%以上;10例依赖红细胞输注的患者中4例(40%)脱离输血依赖,21例患者中4例(19%)脾脏缩小50%以上,泼尼松停药后大部分患者仍有疗效,不良反应较单用沙利度胺小且持续时间短。Weinkove等[8]也用沙利度胺(5mg/d)联合泼尼松(0.5mg・kg-1・d -1)治疗21例MF患者(PMF15例,PV/ET后MF患者6例)。其中5例获大部分反应,1例获部分反应,5例获微小反应,4例治疗无效(EUMNET标准),中位疗效维持时间为16周,不良反应轻微,多为1~2度。雷利度胺治疗PMF贫血的反应率为20%~30%,但尤其适用于伴有del(5q)染色体异常的患者,需密切监测其骨髓抑制毒性。
2、减轻脾脏肿大:
(1) 化疗:首选羟基脲(20~30mg/kg,每周2~3次或1.5g/d),缩脾有效率约40%。2009年美国血液年会上Siragusa等发表了有关羟基脲治疗PMF患者脾脏肿大的研究。结果显示总反应率为35%,JAK2 V617F突变阴性、等位基因负荷<50%及等位基因负荷>50%的患者反应率分别为10%、67%和33%。因此JAK2 V617F突变阴性患者对羟基脲的反应率明显高于阴性者。羟基脲的主要不良反应包括白细胞减少、贫血或红细胞形态异常、血小板减少、消化系统症状、皮肤或黏膜溃疡和神经系统症状。羟基脲无效的患者可以选择其他化疗药物。欧洲白血病网建议的药物包括克拉曲滨(5mg・m-2・d -1,输注2h,连用5d,每月1个疗程,重复4~6个疗程)、马法兰(2.5mg,每周3次)、白消安(2~6mg/d)[9]。6-硫鸟嘌呤(6-TG)及其他烷化剂也被用于治疗PMF。应用化疗药物过程中需密切监测患者血常规指标和白细胞分类,观察患者耐受情况。Fontana等[10]报道了达那唑(200~800mg/d)联合间断应用化疗药物(白消安2~4mg/d或6-TG 50~100mg/d或联合阿糖胞苷100~200mg/m虏)治疗老年骨髓纤维化患者疗效较持久,耐受性好,可作为老年患者的替代治疗。
(2) 放射治疗:存在严重的脾区疼痛、显著的脾脏肿大而有切脾禁忌证、由腹膜髓样化生所致的腹腔积液、脊髓压迫症状或髓外纤维造血性肿瘤的患者可选择放射治疗。缩脾效果显著,但作用不持久(3~6个月)。放射治疗最适用于非肝脾性髓外造血患者,低剂量照射(100~500 cGy,分5~10次分次照射)即有显著效果,但是可能出现治疗相关死亡和持续的血细胞减少。
(3) 脾切除:适用于保守治疗无效的症状性脾脏肿大、依赖红细胞输注的难治性贫血、难治性血小板减少、症状性门脉高压患者。手术禁忌证:
①活动性肝炎;
②严重肺及心血管病;
③血小板计数较高者。切脾可缓解局部压迫症状(50%)、改善贫血(50%)、改善血小板减少(30%)及缓解门脉高压(40%),疗效持续约1年,中位生存期约2年,围手术期死亡率为5%~10%,术后并发症见于约50%的患者,主要包括手术部位出血、血栓形成、膈下脓肿、肝脏进行性肿大、血小板极度增多和伴原始细胞过多的白细胞增多[11]。血小板过多及血栓形成的风险。严重的血小板减少是即将发生白血病转化的标志,切脾对此类患者的总体预后无良好影响。脾脏肿大是拟行造血肝细胞移植患者的不良预后因素,因此有学者建议脾脏显著增大的患者移植前应先行脾切除。
3、改善全身症状:目前认为全身症状与促炎性细胞因子(IL-6)的释放有关。有缩脾效果的治疗一般可以缓解全身症状。
三、试验性药物治疗及进展
目前的药物多姑息性治疗,不能改变PMF的进程,更不能治愈PMF,因此各种新药被积极地投入临床试验。
1、JAK2抑制剂:JAK2 V617F突变发生于约半数的PMF患者。JAK2 V617F突变后,即使无生长信号存在,JH2假激酶域对JH1激酶域的抑制作用消失,使JH1区具有组成行酪氨酸激酶活性,持续磷酸化下游信号分子。常用的JAK2抑制剂分特异性(Ⅰ类)和非特异(Ⅱ类)两种,Ⅰ类主要的作用靶点为JAK家族分子,Ⅱ类同时针对其他分子如FLT3、PKC等。
INCB018424(ruxolitinib)是高效、口服生物利用度高的选择性JAK1/2抑制剂,是目前最接近临床应用的靶向治疗药物。Ⅱ期临床试验[12]选取153例MF患者(PMF和PV/ET后MF患者),包括原有治疗无效、不耐受或复发的患者。结果肯定了INCB018424对MF患者的临床疗效。最大耐受剂量为25mg每日2次或100mg每日1次,中位疗程14.7个月。起始剂量为15mg每日2次时疗效最佳且安全性最高,33例患者中有17例(52%)全身症状迅速改善, 脾脏缩小>50%,疗效 12个月以上。其中14%的输血依赖患者脱离输血。INCB018424对无JAK2 V617F突变的患者也有效。INCB01824还降低了外周血中炎性细胞因子如IL-6、TNF-α的含量。15个月内153例患者中有3例转化为急性白血病(AL),说明INCBO18424可能降低了MF患者的转白风险。INCB018424耐受性好,非血液学不良反映发生率不到10%,且多为1~2度,突然停药会引起“细胞因子反跳”,导致症状复发。血液学不良反映主要是剂量相关性的骨髓抑制,可逆的血小板减少最常见。近期报道了2例(1.3%)患者停药后现全身炎症反映综合征(SIRS)。
TG101348是口服JAK2抑制剂,对JAK2选择性强。I/II期多中心临床试验[13]究了其治疗59例MF患者(PMF44例、PV/ET后MF15例)时的疗效及安全性。确定最大耐受剂量为680mg/d,28d1个疗程,其中73%的患者用满6个疗程,此时39%的患者脾脏明显缩小,57%的高白细胞口才及90%的高血小板患者细胞数降至正常。12个疗程后,47%的口才脾脏缩小,白细胞及血小板恢复正常的比例分别为56%、88%。TG101348也减少血液中促炎性细胞因子的含量,一半以上患者的夜间盗汗、疲劳、皮肤瘙痒及咳嗽症状迅速好转。另外,TG101348可以明显减低JAK2 V617F突变的基因负荷。不良反应为可逆的血清淀粉酶升高,胃肠道反映较大,恶心、呕吐、腹泻、贫血及血小板减少(3~4度)的发生率分别为3%、3%、10%、35%和24%,不良反应与剂量无关。
CEP-701(lestaurtinib)是口服的AK2及FLT3抑制剂,对突变及野生型JAK2均有抑制作用。II期临床试验[14]选取22例JAK2 V617F 阳性的MF(PMF和PV/ET后MF)患者,包括复发、难治、新诊断的有症状的中或高危患者,剂量为80mg,每日两次。其中6例(27%)可达到临床改善(IWG-MRT标准),3例脾缩小50%以上,2例脱离输血,1例脾缩小50% 以上且血小板和中性粒细胞绝对值增加100%以上。中位起效时间为3个月,疗效维持时间大于14个月。CEP-701没有明显降低患者体内细胞因子水平,也未发现JAK2 V617F基因负荷的减低。
8例(36%)的患者出现3或4度不良反应,主要包括骨髓抑制(贫血占14%,血小板减少占23%)和胃肠道反应(腹泻占72%,恶心占50%,呕吐占27%)。美国骨髓增殖性疾病研究联盟主持的CEP-701的多中心I/II期使用了不同的药物剂量与剂型,包括CEP-701口服液(80~100mg,每日2次)和胶囊(100~160mg,每日2次),初步结果显示其在缩脾、降低白细胞、改善输血依赖状态及降低JAK2 V617F负荷方面效果一般,胃肠道反应发生率高,胶囊的耐受性优于口服液。
JAK2抑制性对PMF患者的疗效是明确的,但是PMF的突变基因还包括MPL、CBL、LNK等,因此JAK2的抑制剂疗效有局限性。JAK2抑制剂不仅作用于JAK2,还作用于其他分子如FLT3等,产生不同程度的不良反应。
2、组蛋白去乙酰化酶(HDAC)抑制剂:HDAC家族包括18个基因。对PMF患者CD34+细胞中I~III类HDACmRNA的表达及活性进行定量分析,结果显示HDAC1、2、6、8、10及SIRT1、2、3、5、7表达增加,而HDAC4、5、11、SIRT4表达下调[15]。目前已发现的HDAC抑制剂按结构分为以下几种类型:短链脂肪酸、氧酸类、环型四肽类、苯酸铵类、亲电性酮类及未分类型。
ITF2357(givinostat)为合成的I类及II类HDAC抑制剂。IIA期试验[16]选取12例PV患者、1例ET患者和16例MF(PMF和PV/ET后MF)患者为研究对象,均携带JAK2 V617F突变。起始剂量为50mg,每日2次,平均给药时间为20周。结果显示ITF2357可减轻患者皮肤瘙痒症状,缩脾有效率在MF患者中为38%,7例MF患者完成24周疗程,其中2例达临床改善,5例达到疾病稳定(IWG-MRT标准)。ITF357还可降低JAK2 V617F突变基因负荷。不良反应多为1~2度,主要包括腹泻(62%)、恶心(10%)、胃痛(7%)、贫血(21%)、血小板减少(10%)、疲乏(17%)等,耐受性好。体外试验表明ITF2357对JAK2 V617F阳性的细胞抑制性更强,抑制JAK2 V617F阴性的细胞株生长所需浓度为抑制阳性细胞株所需浓度的100~250倍[17]。
HDAC抑制性LBH589与JAK2抑制剂TG101209可协同诱导MPN细胞的凋亡[18]。2009年美国血液学年会发表的LBH589的IA/II期试验的初步结果显示:在10例PMF患者及3例PV后MF患者中,9例患者出现脾脏缩小及全身症状减轻,疗效可持续39个月。
3、DNA甲基化酶抑制剂:5-氮杂胞苷(5-azacytidine)的II期临床试验[19]选取34例MF(PMF和PV/ET后MF)患者,剂量为75mg/m2皮下注射7d,4周为1个疗程。5个月后起效患者为8例(24%),其中1例(3%)为部分缓解,持续时间大于22个月;7例(21%)床改善(IWG-MRT标准),平均维持4个月。不良反应主要为骨髓抑制,10例(29%)出现3~4度中性粒细胞减少。
4、法尼基酶转移抑制剂:Mesa等[20]主持了R11577(tipifarnib)的II期临床试验。研究对象为34例MF(PMF和PV/ET后MF)患者,剂量为300mg,每日2次,持续给药3周,4周为1个疗程。平均给药时间为4.6个月,治疗肝脾肿大及贫血的有效率为33%和38%。但是患者骨髓纤维化程度、血管生成及细胞遗传学状态无明显变化。不良反应主要包括骨髓抑制、神经毒性、乏力、皮疹及低钠血症。
5、pomalidomide:第三代免疫调节剂pomalidomide的II期多中心双盲临床试验[21]将 MF(PMF和PV/ET后MF)患者随机分成4个治疗组:pomalidomide(2mg/d)联合安慰剂、pomalidomide(2mg/d)联合泼尼松、pomalidomide(0.5mg/d)联合泼尼松和泼尼松联合安慰剂组,28d为1个疗程,3个疗程后治疗贫血的有效率分别为38%、23%、40%、和25%。JAK2 V617F突变状态及染色体核型不影响有效率。pomalidomide的主要不良反应包括中性粒细胞减少和血栓形成,其神经毒性明显低于沙利度胺,骨髓抑制作用明显低于雷利度胺。提高pomalidomide的剂量(>2mg/d)会增加骨髓抑制作用,但并不会提高疗效[22]。近期Begna等[23]进行的II期临床试验表明小剂量(0.5mg/d)pomalidomide对JAK2 V617F阳性患者的疗效明显优于阴性者。
6、重组干扰素α:干扰素α对严重贫血或脾胀肿大的PMF患者疗效极其有限,较多的不良反应也限制了其应用。Silver等[24]选取17例低危及中危-1(IPSS)的PMF患者,给予重组干扰素α-2a 50 ~300万U,每周3次,或聚乙二醇干扰素α-2a 45μ或90μ每周1次,其中完全缓释2例,部分缓解7例,临床改善1例,疾病稳定4例,疾病进展3例(IWG-MRT标准),总反应率越80%,不良反应小,均可耐受。
四、总结与展望
PMF的发生机制复杂,包括多种基因及染色体水平的改变,单药可能不足以改变其发生及发展过程,或许药物联合应用可以逆转PMF的进程,恢复骨髓的造血功能。PMF发生的分子机制有待于更加详细的阐述,这样可以针对多种信号分子进行靶向治疗,从而从多种信号通路抑制PMF的发生及发展。更加特异性的药物有待发现,以增加治疗效果,减少治疗不良反应。另外,适合于西方国家患者的药物及剂量是否同样适合我国患者需要进一步的实验室及临床试验验证。







