- 放化疗治疗脑膜转移癌的治疗方式?
- 发布于 2014-10-16 21:25 来源:王勇医生
脑膜转移又称脑膜转移瘤或柔脑膜转移(LeptomeningealMetastases,LM)是恶性肿瘤细胞广泛转移浸润脑膜、蛛网膜下腔所导致的累及中枢神经系统的严重并发症。其发病率约占所有肿瘤患者并发症的5~10%,随着肿瘤患者生存期的延长,其发病率逐年升高。LM患者的预后很差,即使经过治疗后患者的生存期仍然较低,其中位生存期仅为2~4个月[1-2]。为了缓解症状,延长生存期,提高生活质量,我们对部分LM患者在放化疗的基础上行脑室腹腔分流术(ventriculoperitonealshunt,VP分流)及经Ommaya囊行脑室内化疗等治疗。现对这些病例进行回顾性的分析,探讨神经外科手术在治疗肺腺癌来源的LM中的价值和意义。
1、资料与方法
1.1 一般资料
收集我院2006年6月~2012年2月期间确诊的肺腺癌来源的LM患者的临床资料,并完善随访资料,共纳入39例患者。其中男性16例,女性23例;年龄33~67岁,中位年龄54岁;伴有颅内实质转移灶者20例。确诊原发灶与发现脑膜转移间隔时间为3~28个月,中位时间为13个月。患者以头痛症状最为常见(71.8%,29/39),并伴有不同程度的恶心呕吐、视乳头水肿、四肢乏力,部分患者可查见颅神经受累症状(12.8%,5/39)。接受治疗前两组患者的性别、年龄、KPS评分、临床症状、转移特点以及肺腺癌病程的差异均无统计学意义(均P>0.05),具有可比性。
1.2 诊断标准
患者有明确的肺腺癌病史,伴有新近出现的神经系统症状和体征,并有以下两条中的任意一条便可确诊为肺腺癌脑膜转移:①脑脊液中查见恶性肿瘤细胞。②有单独明确的CT或MRI影像学表现。
1.3 影像学表现
CT平扫多不能发现脑膜转移,增扫描能够显示脑膜强化,为诊断提供价值。但LM的影像诊断仍首选强化MRI[3],其典型表现为脑膜增厚或伴有结节、脑膜线形或条索样强化、脑膜弥漫性强化、有时可见尾征等直接征象,并伴有脑实质容量变小、脑水肿、脑室周围水肿等继发性改变。
1.4 治疗方法
对临床资料进行回顾性分析显示:16例患者行VP分流+Ommaya囊置入;8例患者行单纯Ommaya囊置入,术后均行同步放化疗+辅助化疗+脑室内化疗;15例患者仅行同步放化疗+辅助化疗,其中7例行鞘内化疗治疗。全脑放疗采用6MVX线直线加速器外照射,DT40Gy/20次/4周,放疗期间配合替莫唑胺75mg/(m2・d)同步化疗,持续至放疗结束。辅助化疗采用替莫唑胺(300mg/m2,d1-5)、奈达铂(80mg/m2, d1)、长春新碱(1.4mg/m2,d1)方案化疗,每4周重复。鞘内及脑室内化疗采用阿糖胞苷50mg/m2,每周2次,直至细胞学及标记物完全缓解。
1.5 统计学方法
采用SPSS16.0统计学软件包进行数据分析,用Kaplan-Meier法进行生存分析并绘制生存曲线,组间差异分析采用Log-rank检验,手术前后患者KPS变化采用独立样本的t检验。检验水准设为a=0.05(双侧),P<0.05为差异有统计学意义。
2、结果
39例肺腺癌LM患者均随访至2012年7月9日,术后1例患者出现分流管阻塞,1例患者出现腹腔分流管包裹性积液,VP分流+Ommaya囊置入后患者体力状况明显好转,KPS在术后2周较术前平均提。全组患者平均完成辅助化疗的周期数为3周期,所有患者均死于肿瘤进展。患者总生存时间介于0.6~26个月,中位总生存期为5.1个月,1年生存率为12.8%(5/39)。
根据治疗方式的不同将39例肺腺癌脑膜转移的患者分成:VP分流+Ommaya囊组、单纯Ommaya囊组及非手术组。结果发现行VP分流+Ommaya囊置入组与非手术组的中位生存期分别为7.8个月和3.2个月,组间差异存在统计学意义(2=8.450,P=0.015);VP分流+Ommaya囊置入组与单纯Ommaya囊组的中位生存期分别为7.8个月和5.8个月,组间差异无统计学意义(2=1.355,P=0.244);Ommaya囊组与非手术组间差异无统计学意。
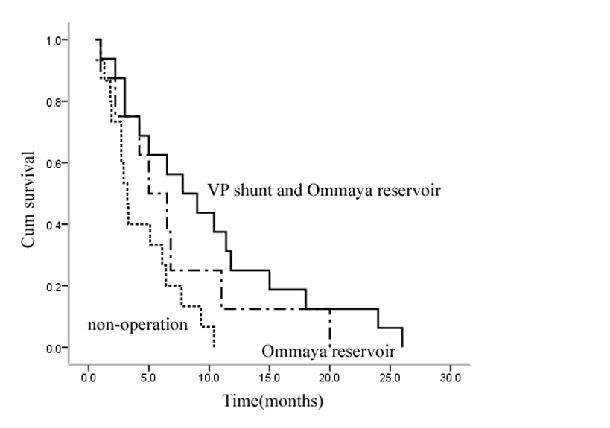
图2 不同治疗方式对患者生存率的影响
Figure 2 Influence on patients’ survival rate with different treatment
methods
3、讨论
随着肿瘤患者生存期的延长以及影像技术的进步,脑膜转移的发病率逐年升高。传统的治疗手段主要包括放疗、全身及鞘内化疗等,由于脑膜转移属恶性肿瘤的晚期,患者体力状况较差,加之治疗相关毒副作用大,治疗效果不理想[1,2,4]。神经外科通过脑室腹腔分流和放置Ommaya囊给予患者脑室内化疗,能够迅速缓解患者临床症状,改善或稳定患者神经功能,提高患者生活质量[4]。
本研究显示VP分流术后2周患者的KPS明显升高(P=0.000),这种患者体力状况在短时间内的明显改善,常常是由VP分流术后颅内高压状况的迅速缓解所带来的。回顾本组患者的临床资料发现,全组患者均有不同程度的颅内压增高表现,其可能的机制为:恶性肿瘤细胞随脑脊液回流时阻塞蛛网膜颗粒,使脑脊液吸收发生障碍从而导致交通性脑积水的发生;此外癌细胞及其代谢产物积蓄在脑脊液中刺激柔脑膜及脑组织产生肿瘤性炎症表现,从而导致广泛或局灶性的脑肿胀,引起颅内压的增高。分流作用可以使脑脊液中的癌细胞得到冲刷和转移,减轻了由于癌细胞广泛播散和种植对脑膜和神经的刺激,而且更重要的是脑室腹腔分流为进一步放化疗治疗争取了宝贵时间。
因此在临床工作中我们应密切观察患者高颅压的症状,在保证安全的前提下,及时行腰椎穿刺测量脑脊液压力和行脑脊液细胞学检查[5],以便明确诊断和采取有效治疗。对于内科治疗不缓解的患者应及时行VP分流术,防止脑疝的发生。当然不可否认通过分流,增加了患者腹腔种植转移的风险,然而在我们的16例行腹腔分流的患者中无一例出现恶性腹水及其它严重的腹腔种植转移并发症。检索国内外相关文献也仅有Lee[6]报道的一例恶性腹水的个案报道。
研究还发现VP分流+Ommaya囊置入组患者的中位生存期(7.8个月)明显高于非手术组(3.2个月),除了VP分流术在迅速缓解患者症状中发挥着重要作用外,通过Ommaya囊行脑室内化疗也是使患者总生存期延长的一项重要原因。与传统的鞘内给药方式相比,通过Ommaya囊给药效果更好,分析其可能的原因在于:脑室内化疗能更好地使药物在脑脊液中均匀分布并能提高疗效,而且通过Ommaya囊行脑室内化疗相对疼痛轻、方便、安全[7]。恶性肿瘤细胞往往通过血液循环侵犯脉络丛然后再进入脑脊液中,腰穿鞘内注射很难使药物逆行进入侧脑室而作用于肿瘤细胞的源头,而Ommaya囊则可使化疗药物均匀的分布于脑室及蛛网膜下腔的各个部位[8,9]。
然而在我们的研究中显示单纯Ommaya囊脑室内化疗组(中位生存期为5.8个月)与非手术组(中位生存期3.2个月)患者的总生存期无明显差异(P>0.05),其主要原因可能是由于Ommaya囊组患者例数太少(n=8),仅占全组患者的20.5%。
因此我们将VP分流+Ommaya囊置入组与单纯Ommaya囊置入组合并,并与非手术组进行比较,结果发现两组患者之间的差异存在统计学差异(2=7.586,P=0.006),而且合并后的差异明显大于VP分流+Ommaya囊置入组与非手术组之间的差异(P=0.006 VSP=0.015),因此经Ommaya囊行脑室内化疗仍视为是一种有效的治疗手段,但仍需大样本多中心的随机对照研究证实。当然由于研究显示注射到脑脊液中的化疗药只能穿透脑实质至室管膜外3mm的距离。因此存在脑实质内转移的患者仍要联合局部放疗和全身化疗[10,11]。
目前经验治疗证实大部分脑膜转移患者能够从全身化疗中获益,主要是考虑到:脑膜转移患者的血脑屏障、血脑脊液屏障遭到破坏;全身化疗能够使鞘内化疗药物渗透不到的病灶得到控制;还能使原发病灶未能控制的患者从中受益。在Oechsle等[12]的一项回顾性研究中发现全身化疗是影响脑膜转移生存时间的重要因素,其作用甚至较局部化疗更加重要。
替莫唑胺是一种新型的口服烷化剂,可透过血脑屏障,进入脑脊液,而且毒性作用小,更加适合恶性肿瘤晚期患者[13]。最近一项研究发现分子靶向药物厄洛替尼治疗肺腺癌脑膜转移效果突出[14],为脑膜转移瘤的治疗开辟了一个新思路,但仍需大量临床试验证实。
总之,我们在研究中体会到在联合全脑放疗及替莫唑胺为主的化疗的基础上根据患者具体情况给予脑室腹腔分流术、经Ommaya囊行脑室内化疗等治疗能够在一定程度上提高患者生存质量、延长患者生存时间。







