- 急性心肌梗死的最佳治疗选择
- 发布于 2010-01-25 09:40 来源:高连如医生
急性心肌梗死是供给心脏血液的冠状动脉突然闭塞,血流中断,使部分心肌因严重而持久的缺血发生局部坏死,从而导致心脏功能的严重损害,死亡率较高。椐统计1/3/-1/2的患者在送至医院之前死亡。
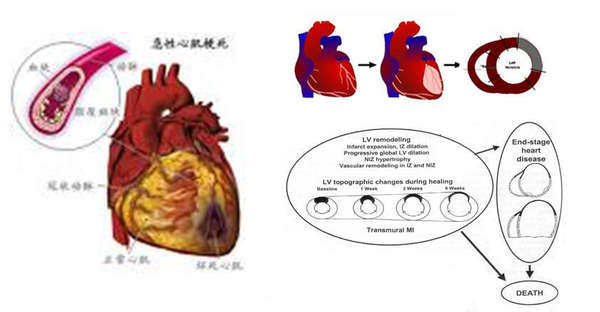
发生心肌梗死时,在心肌灌注突然下降的瞬间,缺血部位的心肌收缩功能和代谢水平也急剧下降,不可逆的心肌损伤发生在冠状动脉堵塞后的15-20分钟。近年来,冠状动脉介入手术直接快速开通闭塞的血管,及药物溶栓治疗,明显降低了急性心肌梗死的早期死亡率。然而,现循证医学研究表明,即使成功接受血运重建治疗的心肌梗死患者中,仍有超过30%的患者经历着心肌梗死后室壁变薄、室腔扩大的心室重构过程,发展为慢性缺血性心力衰竭(CIHF),因为早期血管重建只能挽救顿抑冬眠心肌,而己经坏死心肌必将被纤维结缔组织替代,形成疤痕,最终导致缺血性心肌病,这是目前冠心病死亡的最主要原因。
如下图:冠状动脉闭塞、心肌梗死、疤?形成、室壁变薄、室腔扩大、心力衰竭
如何阻止这个恶性循环呢?这是冠心病急性心肌梗死治疗的瓶颈。因为单一血管重建并不能限制逆转心室重构病理过程,血管重建必须同时进行心肌修复与重建才能根本改善急性心肌梗死患者预后。1998年11月,美国生物学家Thomson与Gearhart等首次分离到人体多能干细胞,已预示着它巨大的医学生物学理论意义及应用前景,被世界科学家称之为当代生物医学发展的最前沿。正是这一发现促进了21世界细胞生物学的飞速发展。应用具有多向分化及自我更新的成体干细胞移植修复心肌的理念应运而生,这是心肌梗死治疗史上一个里程碑性的突破。
干细胞(stem cell)是一类未分化的细胞或原始细胞,是具有自我复制能力、能够分化成为至少一种功能细胞的早期未分化细胞。在一定的条件下,干细胞可以定向分化成机体内的功能细胞,形成任何类型的组织和器官,即具有“可塑性”。根据在个体发育过程中出现的先后次序不同,干细胞可分为胚胎干细胞(embryonic stem cell,ESC)和成体干细胞(adult stern cell)。当受精卵分裂发育为囊胚时,内层细胞团的细胞即为胚胎干细胞。成体干细胞是指那些具有组织或器官特异性的干细胞,具有很强的可塑性,组织类型非常广泛。其中与心肌细胞相关的有骨髓造血干细胞、外周血干细胞、脐血干细胞、骨髓间充质干细胞和骨骼肌干细胞等。
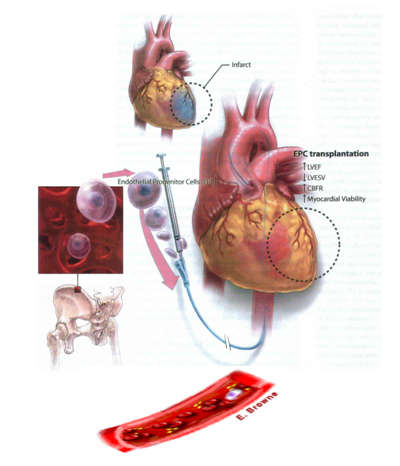
心脏的细胞移植治疗,即直接用分离来的细胞或用经体外纯化、培养和增殖后的细胞,移植到缺血坏死区域,通过新生的肌肉细胞替代纤维组织,从而改善心肌收缩和舒张功能,为心肌梗死和严重心力衰竭治疗提供崭新的治疗方法。
2008年美国JAMA公布了世界范围冠心病细胞移植治疗的临床报道,其中17项细胞移植治疗AMI,16项细胞移植治疗心力衰竭临床研究。大量临床研究发现,干细胞移植有助于改善急性心肌梗死、陈旧性心肌梗死及心肌梗死后心衰临床症状以及梗死后心脏收缩和舒张功能、阻止左室重构、改善预后。其共识是:无论是自体骨髓单个核细胞,还是骨髓间充质干细胞,或内皮祖细胞、骨髓侧群细胞等移植均可不同程度改善心脏收缩功能,可平均提高左室射血分数5-6%,治疗急性心肌梗死、陈旧性心肌梗死及心肌梗死后心衰是安全有益的。
虽然,目前干细y作用机制至今还不十分清楚,但可能机制:1.移植的干细胞分化为具有心肌细胞表型特征的心肌样细胞,增加梗死心肌室壁厚度,限制心室重构; 2.促进血管再生、抗细胞凋亡、动员心肌源干细胞及促进其增殖; 3.干细胞可能是广泛存在于机体各种组织的具有分化潜能及可产生多种生物活性因子的细胞体系,干细胞能表达、合成、分泌多种生长因子、细胞因子、调节肽及气体信号分子等生物活性因子,如产生:①生长因子:血管内皮生长因子(VGF)、胎盘生长因子(PGF)、成纤维生长因子(FGF)、血小板源生长因子(PDGF)、表皮生长因子(EGF)、转化生长因子-ß(TGF-ß);②细胞因子:白介素(L-1-12)、肿瘤坏死因子(TNF)、干细胞因子(SCF)、干细胞衍生因子(SDF-1);③调节肽:脑钠素(BNP)、心钠素(ANP)、内皮素(ET)、肾上腺髓质素(AM)、降钙素基因相关肽(CGRP)等等;这些生长因子 , 细胞因子、化学趋化因子、调节肽等从移植的干细胞进入周围组织,其旁/自分泌因子直接改变心肌愈合过程,包括对血管新生、心肌源干细胞的动员与迁移、抗心肌细胞凋亡、炎症、心肌纤维化、心肌生物能学和内源性修复等多个方面的作用,达到修复心肌,改善心功能效应。因此,在开通了闭塞的冠状动脉,又向心肌播入了种子细胞,这种1+1大于2的事半功倍效果才是急性心肌梗治疗的最佳方案。
闭塞冠状动脉开通支架置入、经导管将干细胞移植至坏死心肌。如图