- Duchenne型肌营养不良治疗新方法是什么?
- 发布于 2016-01-04 21:31 来源:戴毅医生
作为最受关注的基因缺陷性疾病,Duchenne型肌营养不良一直备受国际医疗界、生物医学界关注,各种新发现、新突破都会在第一时间应用到DMD基因治疗上。
刚刚过去的2015年最后一天,国际权威期刊《科学》杂志(Science),一口气在线发表了三篇CRISPR/Cas9基因编辑技术应用于DMD基因治疗的论文。三篇论文分别由美国三家科研机构(哈佛大学、杜克大学和德克萨斯大学)独立完成,并在相近时间投稿。三篇论文全部聚焦在同一主题,就是应用基因编辑技术治疗DMD。
三篇文章有很多共同点:
1、都是利用CRISPR/Cas9技术做删除式基因编辑;
2、都是以DMD最广为应用动物模型-mdx小鼠为研究对象,进行动物体内试验。mdx小鼠DMD基因23号外显子存在一个无义突变,而基因编辑旨在完全删除这一外显子,形成永久性不含外显子23的DMD基因。
3、都是以得到广泛认可的AAV为载体,运载基因编辑的部件进入体内细胞。
4、除了观察到肌肉病理的改善――肌肉细胞膜上重新出现Dystrophin蛋白外,三个团队都证实了治疗后小鼠肌肉力量的增加。
5、都做了多种给药方式,包括肌肉局部注射和静脉注射、腹腔注射全身给药。
6、都证实在全身治疗中,包括心肌在内的全身各肌肉均见到Dystrophin重新表达。
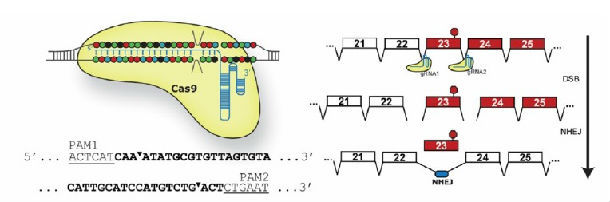
不过,也有一些不同之处。哈佛大学的Tabebordbar团队,尝试了单一AAV9载体运载所有CRISPR/Cas9基因编辑部件,但通过比较,效果不如利用两个AAV9载体,分别运载saCas9和guide RNAs。另外,做了tdTomato报告基因的同步试验,再次证实了体内基因编辑的可行性。杜克大学的Nelson团队应用的AAV载体是AAV8,而不是针对肌肉组织通常选用的AAV9,也取得了不错的效果。德州大学的Long团队则选择了更大的经典型spCas9装载入AAV9。
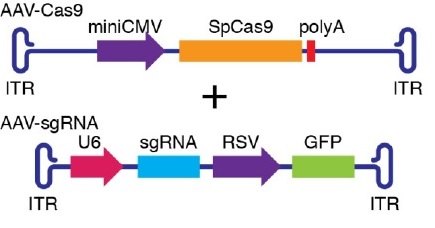
应该说,这是具有里程碑意义的结果。三个团队取得了同样的结果,从而确立了CRISPR/Cas9基因编辑技术在DMD治疗中的潜能。这一新兴治疗的优势包括:
1、基因编辑技术是在DNA水平上完成编辑,一次治疗可以达到永久效果。而不像外显子跳跃那样,需要长期用药。与导入mini-dystrophin(或micro-dystrophin)相比,能够恢复的dystrophin蛋白更接近全长dystrophin蛋白,功能更强。
2、双AAV载体分别运载CRISPR/Cas9部件会成为标准做法,其中AAV-saCas9或AAV-spCas9是通用部件,任何疾病、任何突变都能应用,只需制备不同的AAV-gRNAs,就能靶向不同区段,从而治疗不同的疾病和突变类型。有利于大规模生产,降低成本。就DMD而言,大片段缺失、大片段重复、错义突变、微小缺失、微小重复、剪切位点突变等几乎所有类型的致病突变都可能通过这一治疗系统得到改善。
3、AAV是目前公认的安全载体,已应用于人体临床试验,安全性将进一步得到验证。CRISPR/Cas9基因编辑也应用广泛,很快会在包括肿瘤在内的其他疾病得到应用。因此两者的结合可谓珠联璧合,必将飞速推动DMD等基因缺陷性疾病的基因治疗。
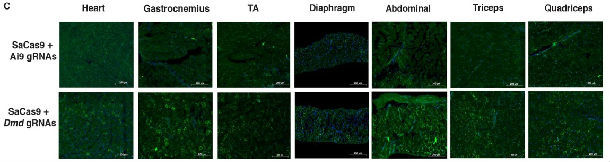
当然,新兴事物肯定还有不完善之处,还需要不断优化。这一治疗系统还存在以下缺点,首先CRISPR/Cas9基因编辑系统的脱靶问题始终存在,也就是在预期编辑区域以外,还有意想不到的DNA编辑之处。这些额外DNA编辑可能会造成不相关蛋白功能缺失或过度激活,从而引发不可预知的严重副作用。只有通过更精细的设计,不断降低脱靶率,并考虑到不同患者基因组的差异性,才能更好的应用于临床。其次,部分人体内已经存在AAV抗体,将明显影响AAV载体定向运载的效率。最后,mdx小鼠虽然是DMD最常用的动物模型,但缺失Dystrophin蛋白的小鼠临床表型却比DMD患者轻很多,完全不影响寿命长短。因此正式应用于患者的真实效果尚有不确定性。小鼠模型与大动物、人体的巨大差异,已在此前多次出现。
新的一年必将预示着新的希望。







